

Rappel
Ionisez la molécule suivante :
H2SO4 ?
Hcl ?
Motivation
Qu’est-ce qui lie la mère et l’époux ?
Annonce du sujet
Qu'allons-nous étudier aujourd'hui?
Analyse
Relation entre αi et Ki
Application de la loi d’action de masse.
Comment écrire la relation ?
Comment s’applique la relation ?
Que devient Ki ?
Que permet cette relation ?
Comment devient Ki si m=n ?
L'ionisation des molécules suivantes :
H2SO4 ?
Hcl ?
La procédure d'ionisation
H2SO4 = 2H+2 ⇌ 2H+2+SO42-
Hcl = HCl -->H++Cl-
C’est la relation qui les unit.
Aujourd'hui, nous allons étudier la relation entre αi et Ki.
Analyse
Relation entre αi et Ki
Il y a une relation mathématique qui relie Ki au αi d'un électrolyte faible.
AmBn ⇌mAn+ nBm-
| E.T. | 1mol | 0 | 0 |
| Etat équation | 1-αi /mol | m αi mol | n αi mol |
| Concentration à l'équation | (1-αi )/v | (m αi )/v | (n αi )/v |
En appliquant la loi d’action des masses,
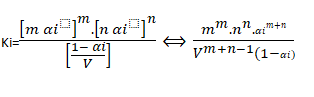
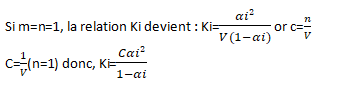
Application de la relation entre αi et Ki
Cette relation permet de calculer le αi pour une concentration donnée si on connait la Ki et vice-versa.
Si l’électrolyte est très faible, on a :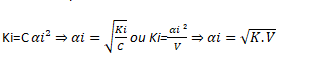
Elle permet aussi de déterminer l’influence de la dilution sur le αi
D’où, la règle de dilution d’Ostwald (le degré d’ionisation si V, C alors αi augmente.
Elle permet également de déduire la force des acides et des bases faibles.
Acides faibles Hr
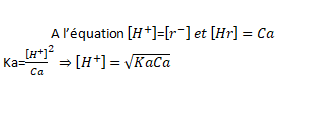
Bases faibles (M OH)
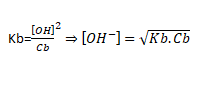
Si m=n la relation Ki devient
