

a) Révision: Un morceau d'alliage de Fer contreront du Nickel et pesant 4,1g est disant par une solution, doHcl à le quelle on ajoute l'acide nitrique. la solution obtenue est traitée par une solution alcoolique de dèmethylgluoxime. le précipité rouge de Ni (C4H7O2N2)2, après séchage pèse 0,2g. calculer le pourcentage en masse de Nickiel dans l'alliage (prend Ma Ni=59)
b) Motivation: comment appel-t-on l'analyse sui se fait par deux solutions?
c) Annonce
Qu'est-ce que nous allons étudier aujourd'hui ?
II. Analyse
Qu'entendez-vous par l'analyse volumétrique ?
Exemple: 1) 25ml d'une solution de H2SO4 sont neutralisés exactement par 30ml d'une solution de NaOH 0,5N. Calculez le normalité et le concentration en g/l de l'acide.
Exemple: Quel est le pourcentage de l'acide oxalique dilydroté dans une préparation donnée si on a dépensé 25,60 ml de solution 0,0900N de potasse caustique pour titrer un échantillon de 0,1500g de cet acide?
3. Dosage acido basique
3.1. Définition: c'est un dosage volumétrique des acides par les bases
3.2. Types : il y a deux types a savoir:
A. L'ACIDIMETRIE: C'est un dosage des acides par les bases
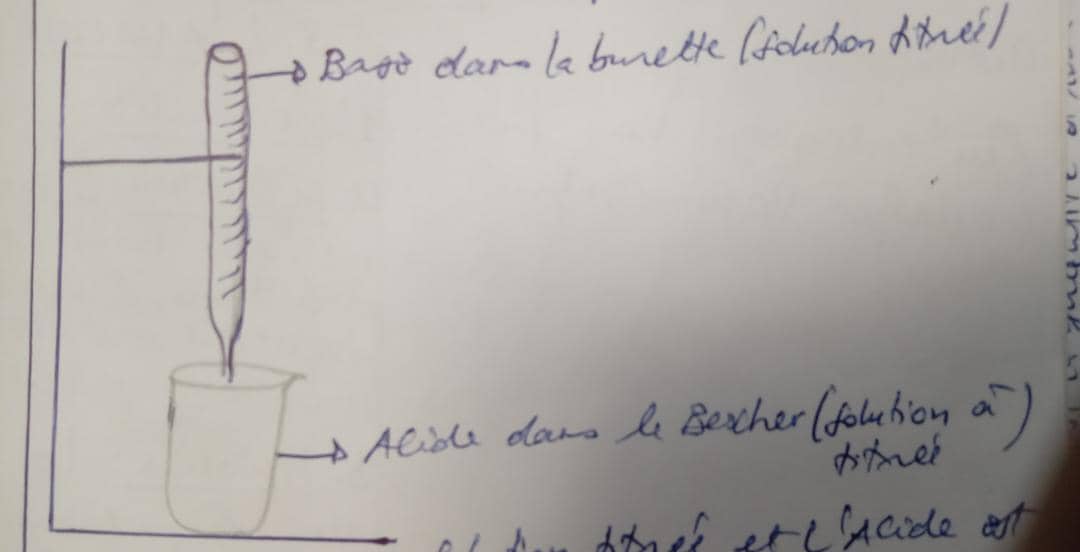
la base est une solution titrée et l'acide est une solution à titrée.
B) ALCALIIMETRIE: c'est un dosage les bases par les acides.
3.3. principe de dosage
3.4. Relation fondamentale
- Au P.E: n éq.A= Méq.B, NaVa=NbVb
