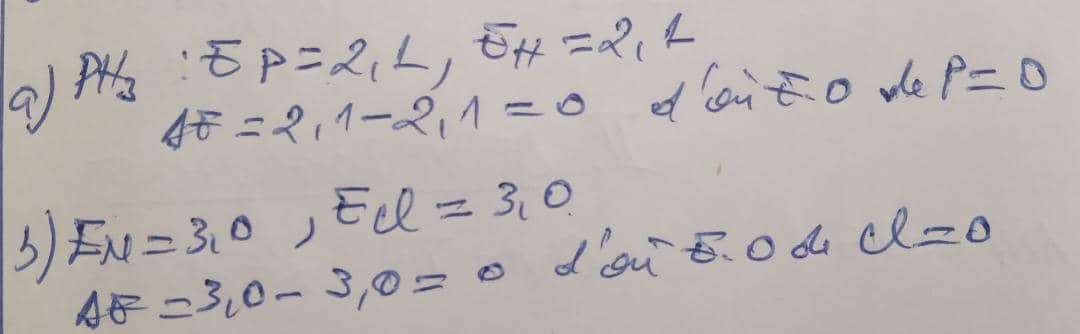a) Révision: A une solution de 300ml d'acide Benzoique 5.10-N (C6H5COOH : pKa = 4,2) , on ajoute 500ml de soude consiste que 10-N Quelle est la valeur du pH?
b) Motivation:
Comment appel-t-on une réaction dont l'oxyd action et le reduction se deroule au même moment
c) Annonce du sujet:
Nous allons étudier quoi aujourd'hui?
II. Analyse
Quel est l'EO des ions suivants ?
a) Ca2+ b) O2- c) Cl- d) Al3+
Quel est l'EO des ions suivants:
a) de s dans HSO4-
b) de Cr dans Cr2 (SO4)3
Trouvez l'E.O de : a) H dans H2. b) Na
Déterminer l'EO de : a) P dans PH3; b) Cl dans Ncl3
Calculez l'E.O de: Fe dans Fe2 (SO4)3; b) Cr dans Cr (SO4)3; c) S dans S2O3-2
Qu'entendez-vous par: 1) OXYDANT
2) Reducteur
3) Forme reduite
4) Forme oxydée.
III. Synthèse
cfr analyse
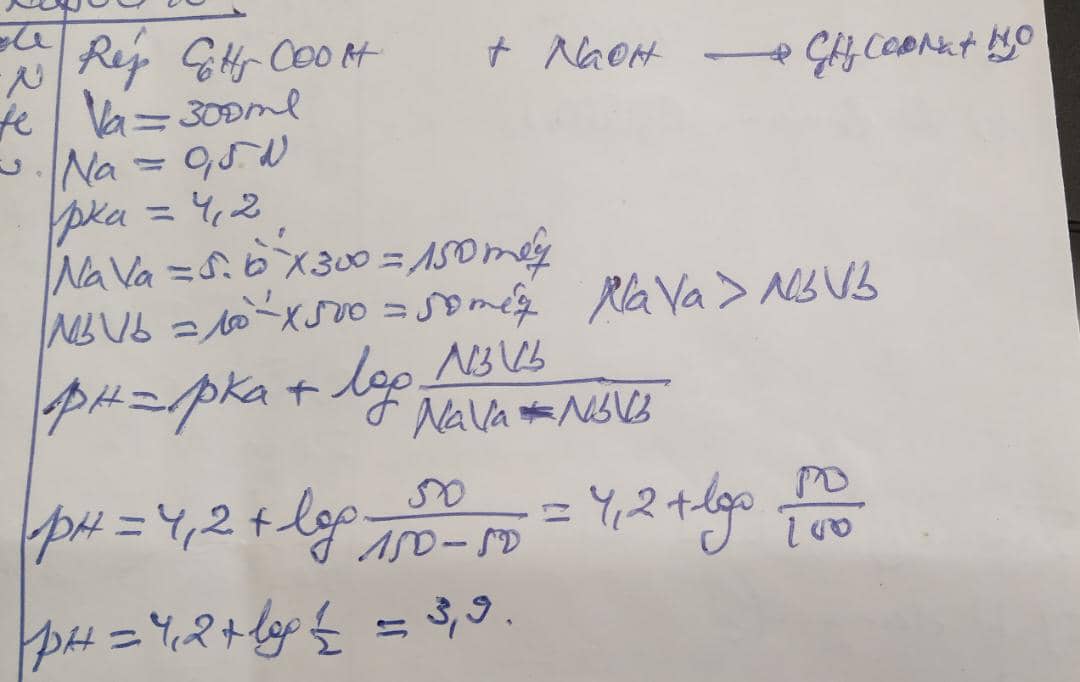
c'est une réaction d'oxydo-réduction
Aujourd'hui nous allons parlé de réaction d'oxydo-reduction.
CHAP III. REACTION D'OXYDO - REDUCTION
1. ETAGE D'OXYDATION (E.O) ou NOMBRE D'OXYDATION (N.O)
1.1.Déf: l'etage d'oxydation ou nombre d'oxydation d'un ion au d'un molécule est le nombre d'électrons perdu ou gagré à l'atome à partir de son état fondamental.
- L'etage d'oxydation est aussi le nombre de charge perdue ou gagné d'un atome ou d'un ions.
1.2. Calcul d'etage d'oxydation
2.1. E.O d'un ion monatomique : c'est le nombre de charge électrique porté par cet ion
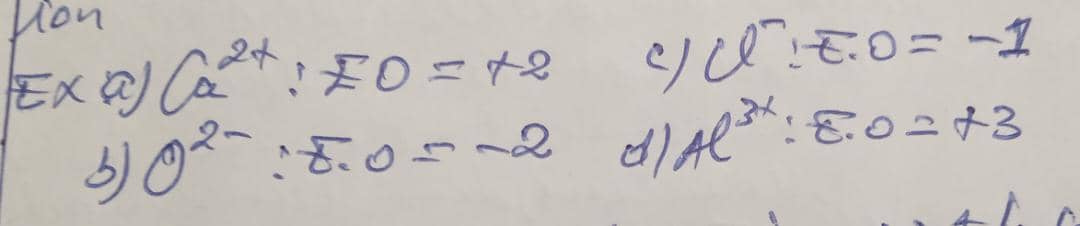
2.2.E.O d'un ion polyatomique : est la somme des E.O des tous les atomes d'un ion polyatomique est égal en valeur et en digne à la charge de l'ion
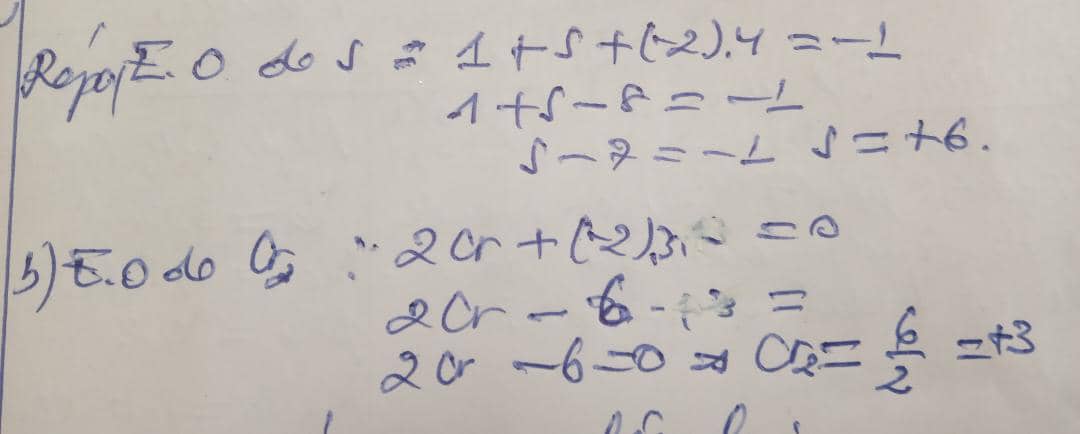
2.3. E.O d'une molécule:
a) E.O d'une molécule simple est égale à zéro(0) car l'électronégativité de cette molécule égale à 0.
Rép a) E.O de H : H2 E.O=0
b) E.O de Na =0
b) E.O d'une molécule composée :
# 1) cas : DE=0, E.0 de chaque de la molécule est égale à zéro.