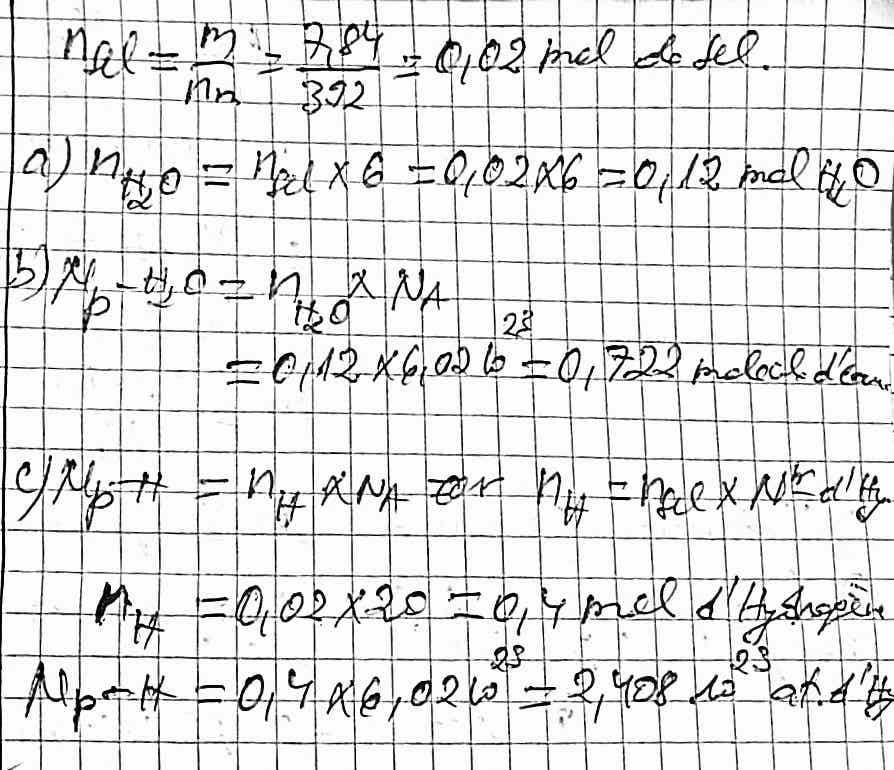1.Vérification de connaissance précédente:
Calculez la masse molaire de :
a) KMn O4
b)Fe SO3
2.Motivation
Comment peut-on connaître le poids molaire de composé H2SO4 et NaOH?
Organisation des classes et consignes
Regrouper les élèves en groupes de 5
Question de recapitilation
Qu'est-ce qu'un volume molaire?
Exemple: la masse molaire du fer est de 56g/mol
a) calculer le nombre de mole d'atome qu'on peut trouver dans 0,28g de metal fer?
b) quelle masse de fer faut-il peser pour avoir 0,18 mol de fer?
calculer le nombre contenu dans 12,041019 atomes de potensium
La mase d'un atome de cuivre est?
Vérification des acquis
1. calculer la masse de plomb qui renferme le même nombre d'atome que 0,5g d'hydrogène
calculer le nombre d'atome de Na dans 2g d'échantillons de sodium
on pèse 7,84g de sel de nom de formule chimique
(NH4)2 SO4. FeSO4.6H2O
a) combien y a t-il des moles?
b) combien y a t-il des molécules d'eau?
c) combien y a t-il d'atomes d'hydrogènes?
a) Mm de KMnO4 =39+55+(4x16)
=39+55+64
=142g/mol
b) FeSO3 Mm=56+32+(3x16)
=39+55+64
=142g/mol
2. Compétence à la situation en déterminant la somme de masse atomique retenue dans le tp
activité dans le tableau spécifique
DONNEES ET EXPRESSIONS QUANTITATIVES
Participation des élèves à la production de la synthèse
1.6 VOLUME MOLAIRE
C'est le volume qui occupe une mole d'un gaz dans les conditions de températureS et de pressions bien déterminées
Vm=22,4 mole dans CNTP
A 200C et 1 atome , Vm=24L/mol
dans l'autre condition: Vm=RT/P
Vm: volume molaire en L/mol
T: température en K/uim
R: =0,082 L atome/mol R.
P: pression en atome en Pa
QUANTITE DE MATIERE (n)
C'est le nombre de mole contenu dans une masse donnée d'une substance
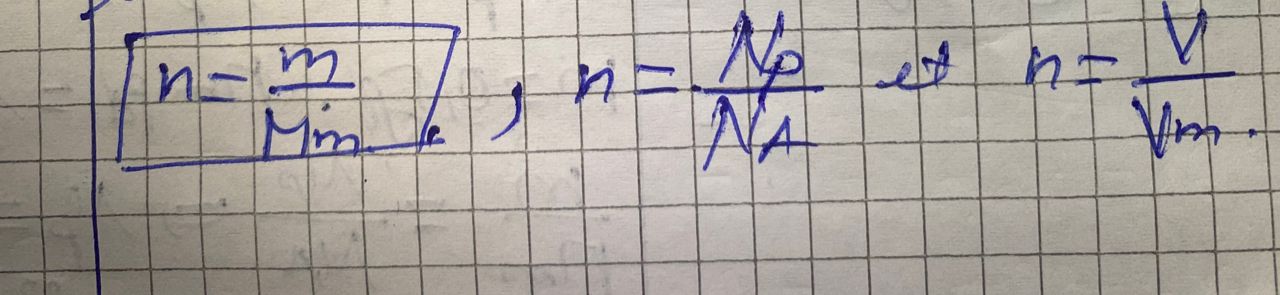
a) données
Mm de Fe =56g/mol
Inconnue
n=?
Formule
n=m/Mm
solutionn=0,28/56=0,005 mol
b) Données
Mm de Fe = 56g/mol
Inconnue
m=?
Formule
m=nxMm
solution
m=0,18x56=10,08g.1 10g
Données
K
Mm=39g/mol
Np=12,041019at/
NA=6,021023
inconnus
n=?
formule
n=Np/NA